Variables thermodynamiques
Équilibre thermodynamique
Équations d'état
Procédé thermodynamique
Notion de travail
Notion de température
Un système thermodynamique est un ensemble matériel de taille macroscopique isolé de son environnement par une frontière réel ou imaginaire. Le nombre de molécules ou de atomes que le constituent est de l'ordre de grandeur du nombre de Avogrado .
Un système a des échanges avec d'autres systèmes avec lesquels il est en interaction. Ces systèmes constituent son environnement.
Un système peut être classé selon les échanges qu'il effectue avec son environnement.
- Système ouvert: celui qui échange de la masse avec son environnement.
- Système fermé: où il n'y a pas de flux de masse à travers ses frontières.
- Système isolée: un système telle qu'il n'y a aucun échange, ni de masse, ni d'énergie avec autres systèmes.
- Système adiabatique: un système fermé, qui n'échange pas de la chaleur avec son environnement. Il peut avoir d'autres formes d'énergie échangées, comme par exemple du travail.
- Homogènes, si constitués d'une seule phase: un gaz par exemple.
- Hétérogènes, si plusieurs phases sont en contact: dans un baromètre à mercure, le liquide et sa vapeur, constituent un système thermodynamique à deux phases.
Variables thermodynamiques
Les variables thermodynamiques sont des paramètres dont la connaissance suffit à définir les systèmes et les différents états dans lesquels il est possible de les rencontrer. Ces paramètres sont des caractéristiques macroscopiques des systèmes.
Pour des systèmes simples les variables thermodynamiques sont:
- Le nombre de moles ni, de chaque espèce chimique i constituant le système.
- Le volume V, grandeur géométrique.
- La pression p, grandeur mécanique.
- La température T, grandeur thermodynamique.
- Variables extensives: celles qui sont multipliées par n quand on passe à un système n fois plus grandes en respectant les mêmes conditions d'équilibre. C'est le cas du nombre de moles, du volume, de la masse, etc. Les propriétés extensives dépendent de la quantité de matière.
- Variables intensives: celles que dans les mêmes conditions ne changent pas de valeur. C'est le cas de la pression de la température, masse volumique, viscosité et toute autre quantité spécifique. Elles sont caractéristiques des substances présentes et indépendantes le leurs quantités.
retour en haut
État d'équilibre
Empiriquement la thermodynamique postule qu'il existe, pour tout système, des états privilégiés vers lesquels tout système isolé tend. Ce sont des états d'équilibre du système. Un système est en équilibre quand, isolé de son environnement, il est stable dans le temps. Ceci implique les trois conditions suivantes:
- Équilibre thermique: La température thermodynamique doit être la même en tous les points.
- Équilibre mécanique: la pression doit être la même en tous les points.
- Équilibre chimique: la composition chimique du système ne varie pas dans le temps.
retour en haut
Équation d'état
À l'état d'équilibre les variables d'état ne sont pas indépendantes. Il existe entre elles une relation fonctionnelle qui on appelle équation d'état du système. Ainsi, pour un gaz, une fois connues la masse (ou le nombre de moles), la température et la pression, le volume occupé par le système est connu.
retour en haut
Procédé thermodynamique
Une transformation ou procédé thermodynamique est n'importe quel changement des variables d'état d'un système. Si pendant la transformation du système les variables d'état du système sont uniformes en tout point du système le processus est réversible. En cas échéante le processus se dit irréversible.
retour en haut
Travail
Le travail est un échange d'énergie entre un système et son environnement. Il y a plusieurs types de travail: mécanique, électrique, chimique, etc. Le travail exécuté quand une masse change de position dans un champ de forces F est donné par:
Quand cette masse se déplace d'un point (1) à un point
(2) dans le champ de forces ![]() le
travail fourni par cette force est
le
travail fourni par cette force est

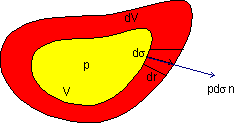
La figure représente une masse de forme quelconque limité par une surface sigma. Si cette surface change parce que le volume du système a changé quel est le travail associé à ce changement de volume?
Soit p la pression à l'intérieur du système. La
pression à l'extérieur doit être égale à
p sinon il existerait une force du au gradient de pression et le système
ne serait pas à l'équilibre. D'autre part nous savons que
la pression est la force par unité de surface. Le champ de force
dans lequel le déplacement ![]() (déplacement
de la surface à cause de l'augmentation de volume dV) se
fait est
(déplacement
de la surface à cause de l'augmentation de volume dV) se
fait est ![]() .
.
D'autre part ![]() =
= ![]() ds
ou
ds
ou ![]() est
le vecteur unitaire localement perpendiculaire à la surface et ds
est le déplacement de la surface. Le travail infinitésimal
fait localement par
est
le vecteur unitaire localement perpendiculaire à la surface et ds
est le déplacement de la surface. Le travail infinitésimal
fait localement par ![]() est alors:
est alors:
Le travail d'expansion réalisé par les changements de forme de la surface s'obtient par intégration de cette équation sur toute la surface.


retour au menu de la page
Température
Les études de la structure de la matière nous font savoir que tout ion, molécule ou atome possède une certaine énergie cinétique due à l'agitation thermique. La température est une mesure de cette agitation thermique. La sensation de chaleur est une manifestation macroscopique de l'agitation qui anime les particules à l'échelle moléculaire. Un corps nous paraît d'autant plus chaud que sa température est élevée.
L'égalité des températures de deux systèmes en contact est une condition nécessaire pour l'équilibre entre les deux systèmes.
La première
loi de la thermodynamique établit qu'il
existe une propriété scalaire universelle appelé température
caractéristique de l'état d'équilibre de tout système
thermodynamique.
retour en haut