Pression d'un gaz
Gaz parfait
Loi de Boyle et Mariotte
Loi de Charles
Loi de Gay-Lussac
Loi d'Avogadro
Équation d'état
Le fait que l'agitation thermique augmente avec la température explique que les substances existent successivement à l'état solide, liquide et gazeux.
À l'état solide, l'agitation thermique est insuffisante pour détruire le réseau cristallin dans lequel les particules sont maintenues en contct les unes avec les autres et en positions fixes.
À l'état liquide, l'agitation thermique s'est assez intensifiée pour provoquer un rupture partielle des liens qui assurent la cohésion de la phase solide; les particules du liquide peuvent alors se déplacer les unes par rapport aux autresmais les liaisons formées entre les particules sont suffisantes pour les maintenir presque aussi proches les unes des autres que le sont les particules du solide.
La substance passe à l'état gazeux
quand l'énergie cinétique des particules devient supérieure
à l'énergie de liaison qui maintenait la cohésion
de la phase liquide. Les particules d'un gaz ne sont pas obligées
de se maintenir en contact et c'est pourquoi elle s'éloignent en
occupant tout le volume disponible.
retour en haut
Pression d'un gaz
Lorsque un gaz se trouve enfermé dans un récipient d'un certain volume, les particules de ce gaz, en se déplaçant continuellement
Gaz parfait
Équation d'état
À l'état d'équilibre les variables d'état ne sont pas indépendantes. Il existe entre elles une relation fonctionnelle qui on appelle équation d'état du système. Ainsi, pour un gaz, une fois connues la masse (ou le nombre de moles), la température et la pression, le volume occupé par le système est connu.
retour en haut
Procédé thermodynamique
Une transformation ouprocédé thermodynamique est n'importe quel changement des variables d'état d'un système. Si pendant la transformation du système les variables d'état du système sont uniformes en tout point du système le processus est réversible. En cas échéante le processus se dit irréversible.
retour en haut
Travail
Le travail est un échange d'énergie entre un système et son environnement. Il y a plusieurs types de travail: mécanique, électrique, chimique, etc. Le travail exécuté quand une masse change de position dans un champ de forces F est donné par:
Quand cette masse se déplace d'un point (1) à un point
(2) dans le champ de forces ![]() le
travail fourni par cette force est
le
travail fourni par cette force est

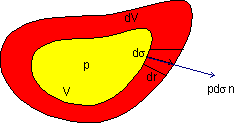
La figure représente une masse de forme quelconque limité par une surface sigma. Si cette surface change parce que le volume du système a changé quel est le travail associé à ce changement de volume?
Soit p la pression à l'intérieur du système. La
pression à l'extérieur doit être égale à
p sinon il existerait une force du au gradient de pression et le système
ne serait pas à l'équilibre. D'autre part nous savons que
la pression est la force par unité de surface. Le champ de force
dans lequel le déplacement ![]() (déplacement
de la surface à cause de l'augmentation de volume dV) se
fait est
(déplacement
de la surface à cause de l'augmentation de volume dV) se
fait est ![]() .
.
D'autre part ![]() =
= ![]() ds
ou
ds
ou ![]() est
le vecteur unitaire localement perpendiculaire à la surface et ds
est le déplacement de la surface. Le travail infinitésimal
fait localement par
est
le vecteur unitaire localement perpendiculaire à la surface et ds
est le déplacement de la surface. Le travail infinitésimal
fait localement par ![]() est alors:
est alors:
Le travail d'expansion réalisé par les changements de forme de la surface s'obtient par intégration de cette équation sur toute la surface.


retour au menu de la page
Température
Les études de la structure de la matière nous font savoir que tout ion, molécule ou atome possède une certaine énergie cinétique due à l'agitation thermique. La température est une mesure de cette agitation thermique. La sensation de chaleur est une manifestation macroscopique de l'agitation qui anime les particules à l'échelle moléculaire. Un corps nous paraît d'autant plus chaud que sa température est élevée.
L'égalité des températures de deux systèmes en contact est une condition nécessaire pour l'équilibre entre les deux systèmes.
La première
loi de la thermodynamique établit qu'il
existe une propriété scalaire universelle appelé température
caractéristique de l'état d'équilibre de tout système
thermodynamique.
retour en haut